
Découverte d’une protéine virale ressemblant au prion
COMMUNIQUE DE PRESSE - Les maladies neurodégénératives, telles que celles de Creutzfeldt-Jakob, Parkinson et Alzheimer, ont en commun la formation et l’accumulation de protéines dans le cerveau qui forment des fibrilles amyloïdes (1). Jusqu’à présent, seules les maladies à prion, également associées à des dépôts amyloïdes, étaient considérées comme transmissibles. Mais récemment, des chercheurs d’INRAE, de l’Institut Pasteur et du campus universitaire d’Heidelberg ont montré qu’un virus infectant les ruminants en Afrique était lui aussi capable de former des amas ressemblant aux fibrilles amyloïdes dans le cerveau. Leurs résultats sont parus le 1er juillet 2020 dans la revue Nature Communications.
Publié le 01 juillet 2020

Le Virus de la Fièvre de la Vallée du Rift (VFVR) infecte l’Homme et le bétail, notamment les ruminants comme les vaches et les moutons via des piqûres de moustiques. Initialement présent en Afrique sub-Saharienne, le virus se dissémine dans d’autres régions proches telles qu’au Moyen-Orient ou sur l’île de Madagascar et pourrait émerger en Europe. Peu d’études ont été menées sur ce virus mais il est avéré que celui-ci est mortel, sans pour autant qu’on sache exactement par quel mécanisme il entraine la mort.
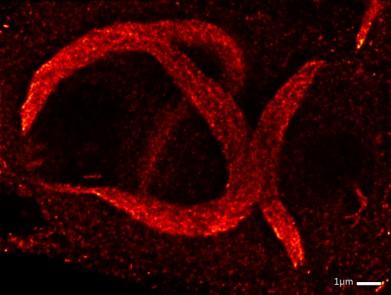
Image en microscopie à super résolution de filaments NSs
Une équipe de chercheurs d’INRAE, en partenariat avec l’Institut Pasteur, l’Université d’Heidelberg et le Centre de Recherche Allemand en Cancérologie, s’intéresse à ce virus, de l’échelle moléculaire à son comportement dans l’hôte. Les chercheurs ont découvert qu’une protéine, NSs, d’origine virale et fabriquée dans les cellules infectées, forment de gros amas semblables aux fibrilles amyloïdes. Les scientifiques ont donc étudié cette protéine sous toutes ses coutures, en combinant différentes approches telles que la biochimie et la microscopie. Ces études leur ont permis de conclure que la protéine formait de longs filaments, qui réagissent au colorant usuel pour marquer les fibrilles amyloïdes. Les observations au microscope ont souligné une grande vitesse de formation, environ cinq heures. Ils ont par la suite pu étudier la protéine dans un contexte infectieux et en concluent que ces fibrilles sont déterminantes dans la capacité du virus à déjouer la réponse immunitaire et sont probablement à l’origine de la virulence du VFVR.
Ces travaux permettent une avancée non négligeable dans la connaissance de ce virus qui constitue un réel enjeu pour les pays africains et leurs voisins. Ces travaux sur la protéine NSs permettent d’établir l’existence d’une nouvelle catégorie de protéines virales capables de former des fibrilles de type amyloïde, comme le prion.
1 Les fibrilles amyloïdes résultent du mauvais repliement et de l’assemblage aberrant de protéines codées par la cellule hôte en fibrilles linéaires hautement ordonnées. À ce jour, environ 50 protéines humaines distinctes ont été identifiées comme formant des fibrilles amyloïdes.
Référence :
Léger P, Nachman E, Richter K, Tamietti C, Koch J, Burk R, Kummer S, Xin Q, Stanifer M, Bouloy M, Boulant S, Kräusslich HG, Montagutelli X, Flamand M, Nussbaum-Krammer C, and Lozach PY (2020). NSs amyloid formation is associated with the virulence of Rift Valley fever virus in mice. Nature Communications, doi:10.1038/s41467-020-17101-y