
Resistance aux antibiotiques : une chronologie inattendue
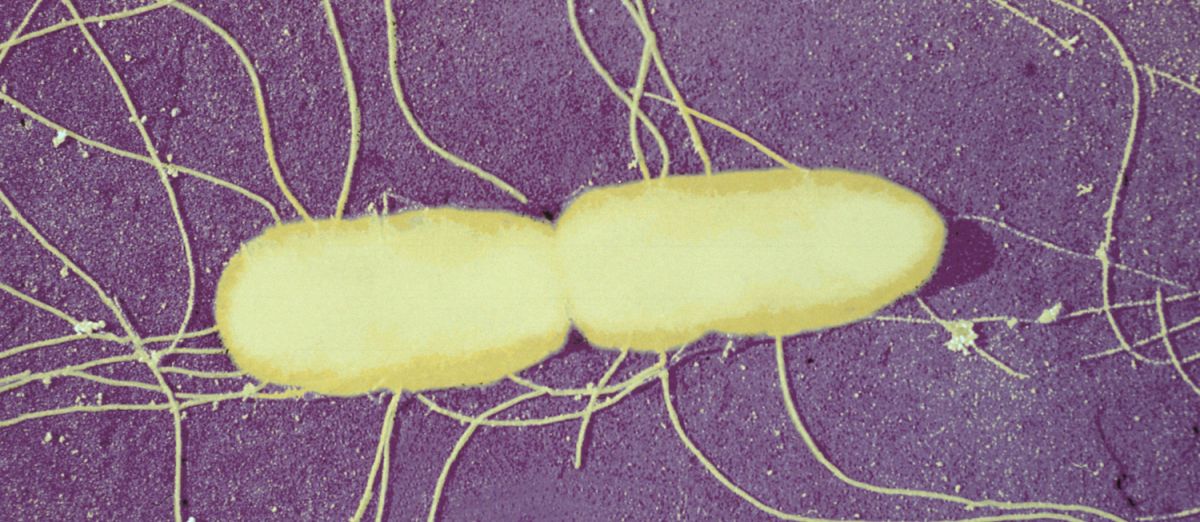
Salmonella typhimurium avec flagelles péritriches (cils).
Espèce bactérienne à l'origine d’infections alimentaires. Image colorisée. © Institut Pasteur
Des chercheurs de l’Institut Pasteur viennent d’identifier rétrospectivement les premières salmonelles résistantes à l’ampicilline, un antibiotique à large spectre encore très utilisé aujourd’hui. Grâce à l’analyse du génome de centaines de souches historiques de Salmonella, ils ont prouvé que l’apparition de cette résistance a précédé la commercialisation de cet antibiotique chez l’homme. Leur découverte suggère que les faibles doses de pénicilline G, administrées au bétail comme promoteur de croissance dans les années 1950 en Amérique du Nord et en Europe, ont pu favoriser l’évolution et la propagation à l’homme de bactéries résistantes à ce nouvel antibiotique quelques années plus tard. Ces résultats sont publiés dans la revue The Lancet Infectious Diseases le 29 novembre.
Chaque année, la résistance aux antibiotiques des bactéries est à l’origine de près de 25 000 décès en Europe. Par ailleurs, il est estimé que, d’ici 2050, cette résistance fera plus de 10 millions de victimes dans le monde. De nombreuses bactéries responsables de graves infections chez l’homme, à l’image des salmonelles, ont déjà développé une résistance aux antibiotiques les plus courants.
L’ampicilline est la première pénicilline de synthèse ayant une efficacité dans le traitement des infections à entérobactéries1. Cet antibiotique dit « à large spectre » est l’un des plus utilisés dans le monde ; il a été commercialisé en Europe dès 1961. Peu après (1962–1964), les premières épidémies provoquées par des souches résistantes à l’ampicilline ont été observées chez l’homme. Ces épidémies, causées par la bactérie zoonotique Salmonella Typhimurium, ont touché la Grande-Bretagne notamment.
Ce délai très court entre la commercialisation de cet antibiotique et les premières résistances décrites dans la littérature scientifique, a incité les chercheurs de l’Institut Pasteur à se pencher sur l’émergence de la résistance à l’ampicilline. Ils ont découvert que des bactéries possédant des gènes capables de transmettre la résistance à l’ampicilline sont en fait apparues, de façon inattendue, dès la fin des années 1950.
Les chercheurs ont pour cela étudié 288 souches historiques de S. Typhimurium isolées d’humains, d’animaux et d’aliments de quatre continents entre 1911 et 1969. La sensibilité aux antibiotiques de ces souches a été analysée et le séquençage complet de leurs génomes a été réalisé pour identifier les mécanismes de résistance à l’ampicilline et comprendre le lien entre les souches résistantes.
Les chercheurs ont identifié plusieurs gènes de résistance à l’ampicilline dans 11 souches (3,8 %) d’origine humaine. Le gène blaTEM-1 a notamment été trouvé sur des plasmides2 dans trois souches isolées en France et en Tunisie en 1959 et 1960, soit plusieurs années avant la commercialisation de cet antibiotique chez l’homme.
Les chercheurs ont remarqué que, malgré la proximité entre les pays, les plasmides recensés en France étaient différents de ceux présents dans le souches responsables des premières épidémies au Royaume-Uni dans les années 1960. « Cela indique que l’émergence précoce de la résistance à l’ampicilline a été causée par des acquisitions multiples et indépendantes de ces gènes de résistance par diverses populations bactériennes, vraisemblablement en réaction à une forte pression antibiotique », précise Alicia Tran Dien, étudiante en thèse et premier auteur de l’article.
L’étude suggère que l’émergence de cette résistance à l’ampicilline pourrait être due à l’utilisation dans les élevages de pénicilline G3. En effet les chercheurs ont démontré que les gènes de résistance à l’ampicilline pouvaient être transférés entre des souches naturelles de S. Typhimurium, lorsque ces souches sont exposées à des niveaux relativement faibles de pénicilline G, semblables aux doses résiduelles retrouvées dans les élevages il y a plusieurs décennies.
« Nos découvertes indiquent que les résidus d’antibiotiques dans les environnements agricoles des années 1950, tels que le fumier, la terre, et les eaux, ont pu avoir un impact bien supérieur à ce que l’on pensait sur la propagation de la résistance à l’ampicilline », révèle le Dr François- Xavier Weill, chef de l’unité Bactéries pathogènes entériques à l’Institut Pasteur, qui a dirigé ces recherches.
« Notre étude n’a pas été conçue pour établir un lien de causalité entre l’utilisation de pénicilline G dans les élevages et l’émergence de la résistance à l’ampicilline ; cependant, nos résultats suggèrent que l’utilisation non médicale de ces pénicillines anciennes a pu favoriser la propagation de gènes de résistance à un nouvel antibiotique efficace chez l’homme. Par conséquent, il est urgent de réévaluer l’usage des antibiotiques chez l’animal, à l’image de ce qui a été fait par la Communauté Européenne au cours des deux dernières décennies, et de mettre en œuvre une approche « one health » pour contrer les résistances en prenant
conscience que les bactéries n’ont pas de frontières. Cela doit passer notamment par une veille étroite des résistances bactériennes, à la fois chez l’homme et chez l’animal, et ce à l’échelle mondiale », ajoute le Dr Weill.
Cette éude est publiée quelques semaines après que l’OMS4 ait appelé à mettre fin à l’usage systématique des antibiotiques chez les animaux d’élevage sains dans le but de favoriser leur développement et de prévenir l’apparition de maladies.
Notes :
1 Les entérobactéries sont une vaste famille de bactéries à Gram négatif comprenant notamment Salmonella, Escherichia coli, Yersinia pestis, Klebsiella et Shigella.
2 Les plasmides sont des éléments mobiles d’ADN pouvant être facilement copiés et transférés entre différentes bactéries.
3 La pénicilline G est un antibiotique à spectre étroit découvert par Alexandre Fleming en 1928, mais seulement produit en masse pendant la seconde guerre mondiale. Dès les années 1950, il a été utilisé en Amérique du Nord et en Europe comme promoteur de croissance, c’est-à-dire donné à faibles doses au long cours dans les rations alimentaires des animaux d’élevage de façon à les faire grossir et donc à augmenter leur valeur marchande.
4 Lien internet :
http://who.int/mediacentre/news/releases/2017/antibiotics-animals-effectiveness/fr/
Financements :
Cette étude a été financée par l’Institut Pasteur, Santé publique France, le Programme d’Investissements d’Avenir du gouvernement français (LabEX IBEID) et la Fondation Le Roch- Les Mousquetaires.
Early transmissible ampicillin resistance in zoonotic Salmonella enterica serotype Typhimurium in the late 1950s: a retrospective, whole-genome sequencing study, The Lancet Infectious Diseases, 29 novembre 2017
Alicia Tran-Dien (a), Simon Le Hello (a), Christiane Bouchier (a), François-Xavier Weill (a) (a) Institut Pasteur
DOI : http://dx.doi.org/10.1016/ S1473-3099(17)30705-3