
Cancer gastrique : une nouvelle stratégie de Helicobacter pylori ciblant les mitochondries
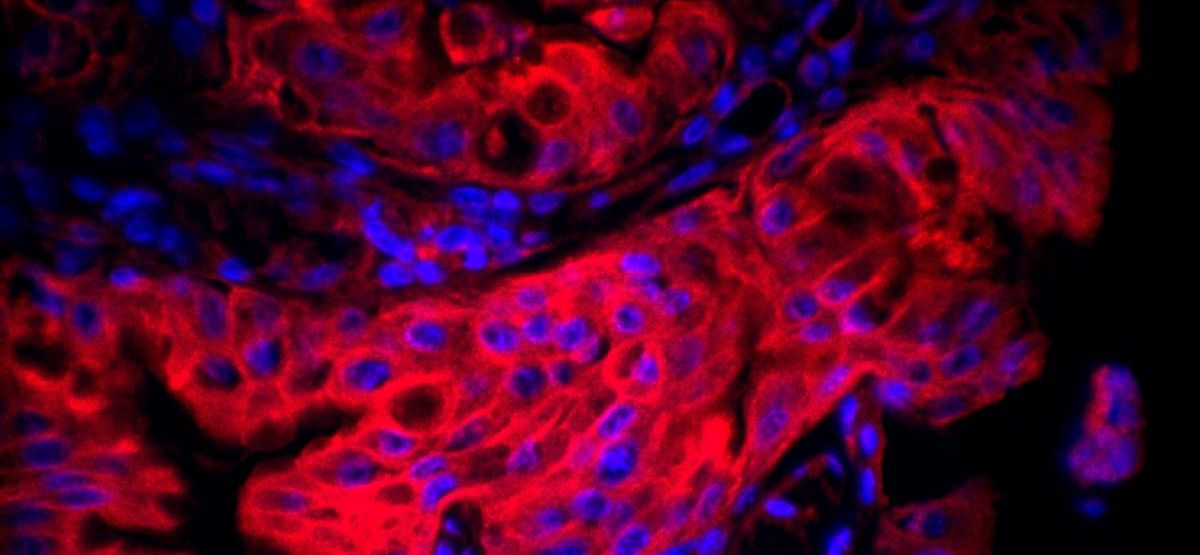
Photo : Tissu gastrique infecté par H. pylori. Les noyaux apparaissent en bleu (coloration Hoechst),
et les mitochondries, en rouge (marquage par MitoTracker).
© Laurent Chatre – CNRS/Institut Pasteur.
Des chercheurs de l’Institut Pasteur et du CNRS viennent d’identifier de nouvelles stratégies utilisées par la bactérie Helicobacter pylori pour infecter les cellules. En ciblant spécifiquement les mitochondries, cette bactérie, bien qu’étant extracellulaire, peut intensifier l’infection subie par l’hôte. Alors que la bactérie H. pylori est associée à la majorité des cas de cancers gastriques, ces découvertes permettent aujourd’hui d’envisager de nouvelles stratégies de lutte contre cette infection et les pathologies gastriques associées. Les résultats de cette étude sont publiés le 21 novembre dans la revue Scientific Reports.
Helicobacter pylori est une bactérie pathogène qui colonise l’estomac de près de la moitié de la population mondiale. L’infection à H. pylori est acquise pendant l’enfance et perdure pendant des décennies. Associée à plus de 80 % des cas des cancers gastriques, cette bactérie en est le principal facteur de risque. Troisième cause de décès dus au cancer, le cancer gastrique fait régulièrement l’objet d’un mauvais pronostic car il est souvent diagnostiqué à un stade avancé. On estime à environ 800 000 le nombre de victimes du cancer gastrique par an dans le monde.
H. pylori présente plusieurs facteurs de virulence qui interagissent avec des cibles spécifiques de la cellule avec des conséquences directes sur la gravité de la maladie gastrique. Parmi les principaux facteurs de la bactérie, la cytotoxine vacuolisante (VacA) était, jusqu’à présent, la seule toxine connue pour agir sur les mitochondries*, provoquant ainsi le dysfonctionnement des membranes des cellules et de leurs organites, et entraînant la mort des cellules.
Des chercheurs de l’Institut Pasteur et du CNRS ont découvert que H. pylori cible les mitochondries en utilisant au moins deux stratégies supplémentaires qui n’entraînent pas la mort des cellules, mais qui permettent le maintien d’un environnement favorable à la prolifération de la bactérie.
Leurs résultats montrent en effet que H. pylori affecte à la fois les systèmes de transport mitochondriaux (qui permettent le transfert des protéines à l’intérieur des mitochondries) et le complexe de réplication et de maintien du génome mitochondrial. Parallèlement, les scientifiques ont constaté que, contrairement à ce que l’on pensait auparavant, VacA n’est pas le seul composant de H. pylori capable d’affecter les mitochondries, ce qui suggère l’existence d’autres facteurs encore inconnus produits par la bactérie.
Comme l’explique Miria Ricchetti, co-dernière auteure et chercheuse à l’Institut Pasteur**, « les altérations causées aux mitochondries par la bactérie H. pylori sont transitoires et disparaissent une fois l’infection enrayée. Malgré un stress remarquable, les mitochondries, comme les cellules, peuvent donc rester fonctionnelles et subir l’infection pendant plus longtemps que prévu. Nous devons maintenant tenir compte de cette situation dans la recherche de stratégies pour inhiber le pouvoir pathogène de cette bactérie. »
Eliette Touati, co-dernière auteure et chercheuse à l’Institut Pasteur**, ajoute : « nous avons remarqué, dans un modèle murin, que ce type d’altération est associé à une aggravation des lésions gastriques. Ces altérations pourraient donc jouer un rôle sur la chronicité et la sévérité de l’infection par H. pylori. La compréhension de ces interactions nouvelles entre le pathogène et les cellules hôtes (via les mitochondries) est essentielle pour développer des stratégies adaptées de lutte contre l’infection par H. pylori. Le but reste de réduire la persistance de la bactérie dans l’estomac et d’endiguer les maladies associées, notamment les cancers. »
* Les mitochondries sont des « centrales » cellulaires qui produisent l’énergie de la cellule (ATP). Elles sont également impliquées dans d’autres fonctions cellulaires essentielles.
** Miria Ricchetti est responsable de l’équipe Stabilité de l'ADN nucléaire et mitochondrial, au sein de l’unité Cellules souches et développement.
Eliette Touati est responsable de l’équipe Infection, génotoxicité et cancer, au sein de l’unité Pathogenèse de Helicobacter.
Pour plus d’informations sur Helicobacter pylori, consulter la fiche maladie : https://www.pasteur.fr/fr/centre-medical/fiches-maladies/cancers-ulceres-gastriques
Helicobacter pylori targets mitochondrial import and components of mitochondrial DNA replication machinery through an alternative VacA-dependent and a VacA-independent mechanisms, Scientific Reports, 21 novembre 2017
Laurent Chatre (1,2), Julien Fernandes (3,4), Valérie Michel (3,4), Laurence Fiette (5,6), Patrick Avé (5,6), Giuseppe Arena (1,2,7,8), Utkarsh Jain (9), Rainer Haas (9,10), Timothy C Wang (11), Miria Ricchetti (1,2) et Eliette Touati (3,4)
1 Cellules souches et développement, Institut Pasteur, 25-28 Rue du Dr Roux, Paris, France
2 CNRS UMR3738, groupe Stabilité de l’ADN nucléaire et mitochondrial, Paris, France
3 Unité Pathogenèse de Helicobacter, Institut Pasteur, 25-28 Rue du Dr Roux, Paris, France
4 CNRS ERL3526, groupe Infection, génotoxicité et cancer, Paris, France
5 Unité Histopathologie humaine et modèles animaux, Institut Pasteur, 25-28 Rue du Dr Roux, Paris, France
6 Université Paris Descartes, PRES Sorbonne Paris Cité, Paris, France
7 IRCM (Institut de recherche en cancérologie de Montpellier), Université de Montpellier, 34298, France
8 INSERM U1194, Montpellier, France
9 Max von Pettenkofer-Institut für Hygiene und Medizinische Mikrobiologie, Ludwig-Maximilians-Universität, Pettenkoferstraße 9a, D-80336, Munich, Allemagne
10 Deutsches Zentrum für Infektionsforschung (DZIF), Ludwig-Maximilians-Universität, Munich, Allemagne
11 Division of Digestive and Liver Diseases, College of Physicians and Surgeons, Columbia University, New York, États-Unis
DOI : 10.1038/s41598-017-15567-3