
Cancer du côlon : la protéine APC agit sur l’immunité en prevenant l’inflammation prétumorale
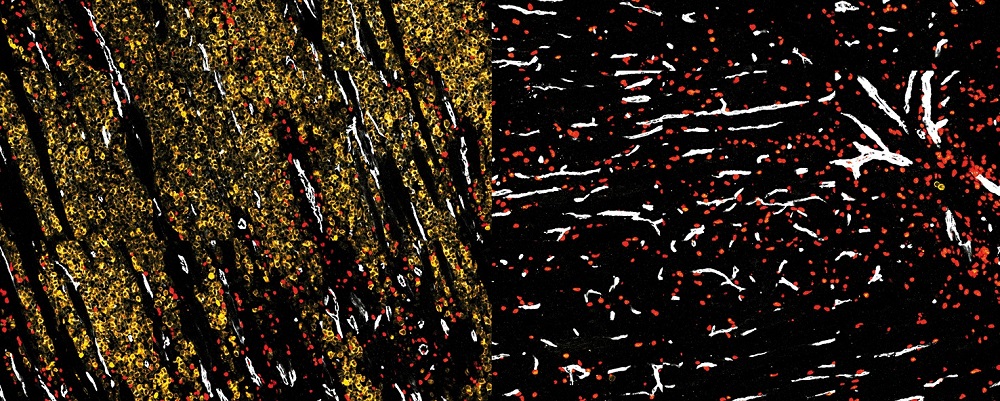
Lymphocytes T humains exprimant ou pas APC.
Le manque d’APC perturbe l’organisation du cytosquelette
de microtubules (filaments verts) © Institut Pasteur
Adenomatous polyposis coli (APC) est un gène dont les mutations sont à l’origine d’une forme de cancer colorectal rare et héréditaire, la polypose adénomateuse familiale. Des chercheurs de l’Institut Pasteur et de l’Inserm viennent de démontrer que les mutations de ce gène initient non seulement l’apparition des polypes intestinaux, mais elles ont aussi un effet néfaste sur le système immunitaire qui ne peut plus lutter contre l’inflammation de la muqueuse du côlon. Un double effet qui favoriserait la croissance du cancer. Cette découverte, publiée dans la revue Cell Reports le 03 octobre 2017, permet d’étendre les connaissances scientifiques sur le mode de développement des cancers colorectaux.
La polypose adénomateuse familiale est une maladie héréditaire. Elle se caractérise, dès la puberté, par l’apparition d’un très grand nombre de polypes intestinaux, des petites excroissances à la surface interne du côlon et du rectum, qui peuvent devenir des cancers. En l’absence de prise en charge, ces polypes dégénèreraient en cancer colorectal avant l’âge de 40 ans.
Alors que le cancer du côlon est l’un des cancers les plus meurtriers, la polypose adénomateuse familiale représente aujourd’hui 1 % de tous les cancers colorectaux. Les personnes qui sont touchées par cette maladie héréditaire doivent donc être surveillées et suivies médicalement.
Des chercheurs de l’Institut Pasteur et de l’Inserm viennent de démontrer que les mutations du gène Adenomatous polyposis coli (APC), connu pour être impliqué dans la polypose adénomateuse familiale, initient non seulement l’apparition des polypes intestinaux, mais elles ont aussi un effet néfaste sur le système immunitaire qui ne peut plus lutter contre l’inflammation de la muqueuse du côlon. Un double effet qui favoriserait la croissance du cancer.
Comme l’explique Andrés Alcover, responsable de l’unité de Biologie cellulaire des lymphocytes à l’Institut Pasteur et dernier auteur de l’étude, « la protéine APC, associée au squelette cellulaire dit des microtubules, a un rôle important sur la structure et la différenciation des cellules épithéliales intestinales. C’est en altérant ces fonctions, dans les cellules intestinales, que des mutations d’APC peuvent conduire au développement de tumeurs. »
Les scientifiques savaient déjà que des altérations d’APC pouvaient influer sur le système immunitaire. Restait à comprendre par quels mécanismes moléculaires et le lien avec le développement du cancer colorectal. Les équipes de chercheurs ont ainsi décrypté comment la protéine APC active un type particulier de cellules immunitaires : les lymphocytes T. « La protéine assure l’activation des lymphocytes T à l’aide d’un facteur appelé NFAT[1], reprend Andrés Alcover. Chez les patients atteints de polypose, le gène est muté, ce qui entraine une déficience en protéine APC et pourrait réduire la présence du facteur NFAT dans le noyau des cellules ». Les lymphocytes ne sont alors plus activés.
Une famille de lymphocytes T, dits « régulateurs », est particulièrement sensible aux mutations d’APC. Les chercheurs ont observé un dysfonctionnement de ces lymphocytes T régulateurs, très présents au niveau de l’intestin, chez des souris portant ces mutations et prédisposées à développer une polypose comme les patients. Ceci conduit à une dérégulation du système immunitaire au niveau de l’intestin et à une défaillance du contrôle de l’inflammation locale. « C’est la première fois qu’on caractérise au niveau moléculaire comment les altérations de la protéine APC agissent sur le système immunitaire, créant des conditions favorables au développement de cancers », souligne Andrés Alcover.
Ces résultats suggèrent donc un double rôle pour les mutations du gène APC dans le développement du cancer colorectal. Non seulement, les mutations initient l’apparition des polypes, mais elles réduisent également l’action du système immunitaire qui n’est plus capable de contrôler l’inflammation de l’intestin. Un cercle vicieux qui favorise la croissance du cancer.
Reste à savoir si les altérations de la protéine APC chez les patients de polypose familiale entrainent des conséquences sur d’autres cellules du système immunitaire, en particulier sur celles qui éliminent directement les cellules cancéreuses. Si tel est le cas, l’ensemble de ces travaux pourraient aider à la mise au point de nouvelles thérapies pour soigner plus efficacement les patients atteints de polypose adénomateuse familiale ou d’autres cancers intestinaux.
[1] NFAT : facteur nucléaire des lymphocytes T activés.
Ce projet a été financé par la Fondation ARC pour la recherche sur le cancer, l’Institut Pasteur, l’INSERM, l’ANR, le NIDDK-USA, et The People Programme (Marie Skłodowska-Curie Actions) of the European Union's Seventh Framework Programme FP7/2007-2013/ under REA grant agreement n°317057 HOMIN-ITN.
* Adenomatous polyposis coli defines Treg differentiation and anti-inflammatory function through microtubule-mediated NFAT localization, Cell Reports, 3 octobre 2017
Sonia Agüera-González (1,2,3,5), Oliver T. Burton (4,8), Elena Vázquez-Chávez (1,2,3), Céline Cuche (1,2,3), Floriane Herit (1,2,3,6), Jérôme Bouchet (1,2,3,6), Rémi Lasserre (1,2,3,7), Iratxe del Río-Iñiguez (1,2,3), Vincenzo Di Bartolo (1,2,3), Andrés Alcover (1,2,3)
1. Institut Pasteur. Department of Immunology. Lymphocyte Cell Biology Unit,
2. CNRS URA1961.
3. INSERM U1221. 75015 Paris, France.
4. Division of Immunology, Boston Children's Hospital and Department of Pediatrics, Harvard Medical School, Boston, MA 02115, USA.
5. Institut Curie. Membrane and Cytoskeleton Dynamics Group, CNRS UMR144, 75005 Paris, France.
6. Institut Cochin, INSERM, U1016, CNRS, UMR8104, Université Paris Descartes, Sorbonne Paris Cité, 75014 Paris, France.
7. Centre d’Immunologie de Marseille-Luminy, Aix Marseille Université UM2, Inserm, U1104, CNRS UMR7280, 13288 Marseille, France.
8. Department of Microbiology and Immunology, VIB-University of Leuven, 3000 Leuven, Belgium.
DOI : https://doi.org/10.1016/j.celrep.2017.09.020